登录/注册后可看大图
近期,CFDA分3次公布了6批参比制剂目录,引来业界一片哀嚎。本文将以卡托普利片为例,抛砖引玉的谈谈参比制剂遴选。
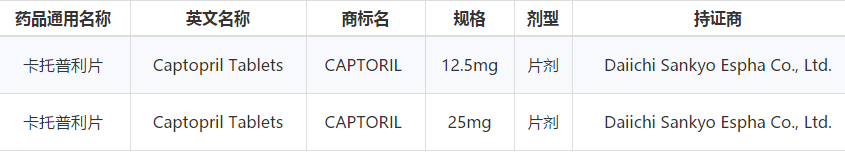
CFDA在6月9日的第5批参比制剂目录中公布了12.5mg和25mg卡托普利片的参比制剂,参比制剂厂商为日本的第一三共株式会社。
点击图片放大查看更清晰
笔者核实了一下,该产品确实在日本上市,且被橙皮书收录为参比制剂,甚至还赋予了原研身份(见下图箭头)。这里似乎显示了CFDA公布这个参比制剂的依据。
点击图片放大查看更清晰
那么,为什么业界大佬们还在为此争论呢?为了解释这个问题,笔者将通过参比制剂遴选原则来一步步揭秘,同时验证CFDA公布参比制剂的正确性。
1、首选国内上市的原研药品
第一步就是找原研了,笔者通过药群网全球药品研发数据库查得卡托普利的原研企业为施贵宝,当然也提到了第一三共株式会社。
点击图片放大查看更清晰
为了进一步验证获取信息的正确性,笔者又查阅了Cortellis和默克索引(如下图),基本验证了原研企业为施贵宝。
点击图片放大查看更清晰
另外,笔者在查找过程中发现一件很有意义的事儿,第一三共株式会社在药品的IF文件中也提到了原研为施贵宝。到此,基本可以确定卡托普利的原研是施贵宝了。
点击图片放大查看更清晰
进一步查询数据发现,国内没有进口的卡托普利制剂,只有爱尔兰的原料药。中美上海施贵宝制药有限公司有地产化的卡托普利片剂,但是查询参比制剂备案数据库发现该公司并未申报参比制剂。因此,第1个遴选原则不符合。
2、国内上市国际公认的同种药物作为参比制剂
由于国内没有进口的卡托普利制剂,这一条也直接跳过。
3、欧盟、美国、日本上市并列为参比制剂的药品
看来只能按照这一条来遴选参比制剂了。
查询FDA和PMDA发现,美国和日本没有上市施贵宝公司的卡托普利片。而美国FDA橙皮书收录的参比制剂为PAR PHARMACEUTICAL INC的CAPOTEN,不过该参比制剂已经撤市。
点击图片放大查看更清晰
Cortellis报告也证实了这一点,施贵宝虽然获得了全球大多数国家的独家权利,但美国和日本的独家权利却被Par和Sankyo分别取得了。
点击图片放大查看更清晰
信息显示,施贵宝的卡托普利片在1981年首先被爱尔兰批准,商标名为Capoten,现有规格为25mg和50mg。
点击图片放大查看更清晰
1984年,施贵宝的卡托普利片在法国被批准,商标名为Lopril,现有规格为25mg和50mg。
点击图片放大查看更清晰
另外,欧洲其他国家也有施贵宝的卡托普利被批准,比如英国(25mg)、意大利(25mg/50mg)等。不过均未发现12.5mg的规格。
综上所述:卡托普利片的参比制剂最终结果分为两类:
第一、12.5mg的参比制剂选择日本第一三共株式会社的产品。
第二、25mg/50mg两个规格的参比制剂选择施贵宝在爱尔兰上市的产品。
点击图片放大查看更清晰
不过,根据CFDA 6月8日发布的《关于仿制药质量和疗效一致性评价工作有关事项的公告(征求意见稿)》第七条来看,中美上海施贵宝的12.5mg和25mg卡托普利片可选为参比制剂,不过这应在正式稿出来后确定。同时,历史数据显示,施贵宝的卡托普利片最早于1995年在国内上市,原批准文号沪卫药准字(1995)第033002号。
点击图片放大查看更清晰
点击图片放大查看更清晰
| 欢迎光临 药群论坛 (http://yaoqun.net/) | Powered by Discuz! X3.2 |